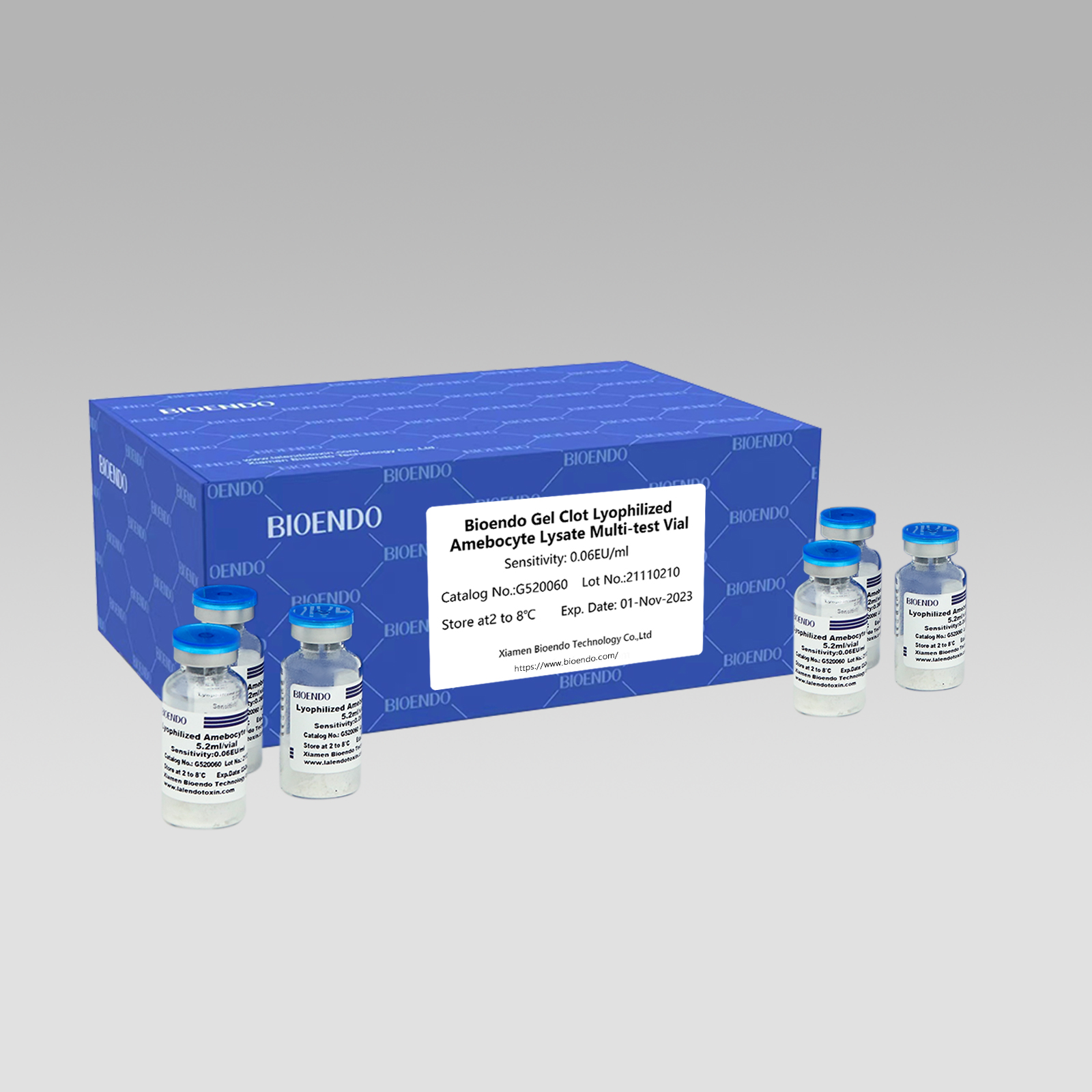
Gel Clot Lyophilized Amebocyte Lysate Multi-Test Vial G52
Bioendo G52 Serie ass haaptsächlech am Experiment Operatioun vun benotztbakteriell Endotoxin Testals Bioassay Prozedur.
1. Produit Informatiounen
Gel Clot Method Lyophilized Amebocyte Lysate Multi-Test Vial ass de Lyophilized Amebocyte Lysate Reagens deen Gel Clot Technik auswielt a benotzt fir Endotoxin oder Pyrogen z'entdecken.
Wéi déi verbreet Method, Gel-Clot Test fir Endotoxin ass einfach an erfuerdert kee spezifescht an deier Instrument.Bioendo bitt Gel Clot Lyophilized Amebocyte Lysate - LAL Reagens a 5.2ml pro Fläsch.
2. Produit Parameteren
Sensibilitéitsberäich: 0,03 EU/ml, 0,06 EU/ml, 0,125 EU/ml, 0,25 EU/ml, 0,5 EU/ml
3. Produit Applikatioun
Endprodukt Endotoxin (Pyrogen) Qualifikatioun, Waasser fir Injektiounendotoxin Assay, Matière premièreendotoxin Testenoder Endotoxin Niveau Iwwerwachung während Fabrikatioun Prozess fir pharmazeuteschen Firmen oder medezinesch Apparater Hiersteller.
Notiz:
Lyophilized Amebocyte Lysate (LAL Reagens) hiergestallt vu Bioendo ass aus Lysat vun Amebocyten (wäiss Bluttzellen) aus der Houfeisenëmlafbunn gemaach.
Dësen eenzegaartege Reagens ass e wesentlecht Tool an der pharmazeutescher a medizinescher Apparatindustrie fir d'Detektioun vu bakteriellen Endotoxine ginn.D'Amebozyten vun der Houfeisenkrab enthalen eng Substanz genannt Lyophilized Amebocyte Lysate, déi op bakteriell Endotoxine reagéiert andeems e gelähnleche Clot geformt gëtt.Dës Reaktioun ass d'Basis fir den LAL Test, benotzt fir d'Sécherheet vu medizineschen Apparater, Drogen an aner Produkter ze garantéieren, déi mam mënschleche Kierper a Kontakt kommen.
D'Benotzung vun LAL reagent huet de Prozess vun revolutionéiertEndotoxin Detektiounam medizinesche Beräich wéi de Rabit Test Assay.Seng onparalleléiert Sensibilitéit a Spezifizitéit maachen et zu engem entscheedende Bestanddeel an der Qualitéitskontroll a Sécherheetssécherung vu Medikamenter, Biologeschen a medizineschen Apparater.De LAL Test ass eng séier an zouverlässeg Method firEndotoxin Detektioun, suergt Resultater an esou wéineg wéi 60 Minutten.Dës Effizienz erlaabt séier a präzis Entscheedungen iwwer d'Verëffentlechung vu Produkter, schlussendlech verbessert d'allgemeng Sécherheet an d'Effizienz vu medizinesche Behandlungen an Apparater.
Bioendo's Lyophilized Amebocyte Lysate (LAL Reagens) gëtt ënner strenge Qualitéitsnormen produzéiert fir seng Effektivitéit an Zouverlässegkeet ze garantéieren.D'Firma ass gewidmet fir nohalteg Praktiken an der Ernte vun Houfeisenëmfeld ze benotzen fir all negativ Auswierkungen op hir Bevëlkerung ze minimiséieren.Duerch d'Prioritéit vum Wuel vun dëse Kreaturen suergt Bioendo fir eng weider Versuergung vun dëser wäertvoller Ressource fir d'Produktioun vun LAL Reagenz.Zousätzlech, lafend Fuerschung an Entwécklung Efforten sinn op d'Verbesserung vun der Leeschtung an Villsäitegkeet vunLAL Test Endotoxin, weider hir Déngschtleeschtung an der medizinescher a pharmazeutescher Industrie weiderzeféieren.
Gel Clot MethodLAL Assay, rekonstituéiert Lysatreagens kritt op d'mannst 50 Tester pro Fläsch:
| Katalognummer | Sensibilitéit (EU/ml oder IU/ml) | ml/fläsch | Tester / Vial | Fläschen / Pack |
| G520030 | 0,03 | 5.2 | 50 | 10 |
| G520060 | 0,06 | 5.2 | 50 | 10 |
| G520125 | 0,125 | 5.2 | 50 | 10 |
| G520250 | 0,25 | 5.2 | 50 | 10 |
| G520500 | 0,5 | 5.2 | 50 | 10 |
Produkt Zoustand:
De Lyophilized Amebocyte Lysate - LAL Reagensempfindlechkeet an d'Kontroll Standard Endotoxin Potenz gi géint USP Referenz Standard Endotoxin getest.D'lyophiliséiert Amebocyte Reagenskits kommen mat Produktinstruktioun, Analysezertifika, MSDS.
Wat ass den Ënnerscheed tëscht Bioendo Single Test Vial a Multiple Test Vial?
● Single Test: rekonstituéieren der SingleLimulus Lysat Testoder genanntlimulus amebocyteduerch BET Waasser am Glas Fläsch oder Glas Ampullen.
● Multi-Test: rekonstituéiert de Lysatreagens mat BET Waasser, a füügt dann e markéierte Betrag vum Lysatreagens no COA an d'Reaktiounsröhre oder d'Bunnplack fir ze benotzen.Et gëtt keen Ënnerscheed am Prouf Pre-Veraarbechtung Prozedur;Geméiss dem Betrag vun Tester benotzt, ass d'Probegréisst, déi fir een eenzegen Test benotzt gëtt, méi grouss wéi d'Probegréisst, déi fir verschidde Tester benotzt gëtt.
Firwat de Gel Clot Assay Kit G52 speziell fir Mass Echantillon Quantitéit?
1. Multi-Test LAL-Reagens fir Endotoxin-Erkennung an den Uwendungen vu Masseproben 'LAL Assay Operatiounsprozeduren.
2. G52 Serie vu Gel Clot Endotoxin Assay Multi Test Glas Fläsch brauch kee sophistikéierte Mikroplate Lieser.Am LAL Assay ass seng Prozedur vun der Inkubatioun duerch Waasserbad oder dréchen Hëtzt Inkubator praktesch Apparat.
3. Héich Enn Qualitéit vun Endotoxin fräi Rouer (<0.005EU / ml) an Héich Qualitéit vun pyrogen gratis Tipps (<0.005EU / ml) als garantéiert consumables fir déi richteg Resultat ze garantéieren.
4. Fir Bioendo Single LAL Test Fläsch oder Multi LAL Test Fläsch duerch Proben Quantitéit ze wielen, ass d'ZilLAL Test fir Pyrogenenerkennen.
Verwandte Produkter am Endotoxin Test Assay:
Waasser fir bakteriell Endotoxine Test (BET), recommandéiert TRW50 oder TRW100
Endotoxinfräi Glasröhre (Verdünnungsröhre), empfehlen T1310018 an T107540
Pyrogen fräi Tipps, Recommandéiert PT25096 oder PT100096
Pipetteur, PSB0220 recommandéieren
Test Tube Rack
Inkubatiounsinstrument (Waasserbad oder Trockenheat Inkubator), fir Bioendo Dry Heat Incubator TAL-M2 ze recommandéieren ass 60 Lächer ee modulär.
Vortex Mixer, recommandéieren VXH.
Kontroll Standard Endotoxin, CSE10V.